Biológiai blogként nem mehetünk el szó nélkül a hetekben dúló influenza-mánia mellett. A hírek középpontjában levő madárinfluenza vírusról a budapesti Állatorvosi Kamara honlapján lehet egy remek összefoglalót olvasni. Ennek az egyik legfontosabb következtetését kiemelném, mert nem árt ismételten hangsúlyozni, az urban-legendek terjedését megelőzendő:
Influenza-para
Néhány dolgot azonban még hozzáfűznék az összefoglalóhoz. A szerzők (szerintem kicsit optimistán, hogy miért, lásd később) a pandémiás influenza törzseket a populációkban keringő madár- és ember influenzavírusok közötti kombináció eredményének tartják, amelyhez az – a viszonylag alacsony valószínűségű esemény – szükséges, hogy valaki (vagy valami, hiszen a disznó is lehet mindkét vírus hordozója) egyszerre fertőződjön meg a két vírussal. Kétségtelen, hogy leggyakrabban ez a helyzet, a múlt század három leggyilkosabb influenza járványa közül kettő valóban így keletkezett. Az 1957-es „ázsiai influenza” (H2N2) esetében az influenzavírus genomját alkotó 8 szimpla-szálú RNS szegmens közül 3 egy madárinfluenzából származott, míg az 1968-as Hong Kong-i törzs (H3N2) esetében az előző vírus 7 szegmense mellé egy madár- (kacsa-) influenza vírus -szegmens csapódott. (Néhány vélemény szerint az arány 6-2 volt, de ez a lényegen nem változtat.) Azonban a hetekben megjelent kutatások eredménye szerint az 1918-19-es, minimum 40 millió áldozattal minden idők leggyilkosabbjának számító „spanyol nátha” (H1N1) esetében nem ez történt. A Nature október 6-i számában megjelent cikk [2] szerzői szerint (mint azt az újság podcastjában is megjegyzik) a H1N1-vírus teljes egészében madár eredetű, de bizonyos változásokkal adaptálódott az emberekre/emlősökre (hogy mi lehetett az átmeneti gazda, ahol ez az adaptáció történt, az még kérdéses) [3]. Hogy a szerzők megfogalmazásával éljek: a H1N1 a „ legmadárvírusszerűbb” emlős influenzavírus. Tandemben ezzel a cikkel a Science a rekonstruált 1918-as vírus virulenciájáról közölt egy tanulmányt [4]. Az adatok félelmetesek és lenyűgözőek egyszerre: a „spanyol nátha” vírusát alkotó nyolc szegmens kombinációja emberi tüdőszövetben egy nap alatt 50-szer, egér tüdőszövetben pedig négy nap alatt 39.000-szer annyi vírus részecskét termelt, mint a napjainkban is elterjedt influenzavírusok. Emellett, szintén szöges ellentétben napjaink vírusaival, a betegség lefolyása halálos az egerekben és - mintegy a madárinfluenza-eredetet bizonyítandó - a megfertőzött csirkeembriók pusztulását is okozza, ami szintén nem jellemző a humán influenzavírusokra. (Ugyanakkor megjegyzendő, hogy egyedül az 1918-as szegmes kombináció ennyire veszélyes, egyetlen szegmens kicserélése drasztikusan csökkenti a virulenciát és letalitást.)Ami miatt ebben a tekintetben napjaink „sztárja”, a H5N1 figyelemreméltó, az, hogy egyes izolátumokban megjelent néhány kulcsfontosságú mutáció, ami a „spanyol náthát” (és az azt követő, belőle kialakuló 20. századi ember influenzát) egyértelműen megkülönbözteti a madárinfluenza-vírustól. Pánikra egyértelműen nincs még ok, hiszen egyelőre még csak egyedi esetekről van szó, ahol a 25 kitüntetett mutációból egy-egy jelent meg, de intő jelként szolgál, hogy a molekuláris evolúció nem tétlenkedik, s az 1918-as járvány a jövőben megismétlődhet. Az említett két cikk azzal is kisebb vihart kavart, hogy a folyományukként a „spanyol nátha” teljes genomja megtalálható az NCBI adatbázisában, hiszen ez a mai standardok szerint a publikáció alapfeltétele. Ennek következtében néhányan elkezdték kongatni a vészharangot, hogy ezzel kvázi egy igen hatásos biológiai fegyver „tervrajza” juthat illetéktelen kezekbe. Azonban, mint arra mindkét újság szerkesztősége rámutat [5,6], a félelmek kissé eltúlzottak: egyrészt azért, mert napjainkban létezik mindenkiben egyfajta természetes immunitás a H1N1-el szemben, másrészt mert a HA-t illetve NA-t kódoló vírusgéneket tartalmazó oltások bizonyítottan védelmet biztosítanak. Akárcsak számos ma használt zanamivir, amatadine vagy oseltamivir alapú antivirális szer.
És ezek említésével vissza is kanyarodunk az elején kiemelt idézethez. Az igen bizonytalan, hogy a ma ismert H5N1-törzs(ek) elleni védőoltások mennyire lesznek protektívek egy esetleges pandémikus influenza felbukkanásakor, az azonban valószínűsíthető, hogy az említett antivirális szerek nyújtanak majd valamennyi védelmet. Nem véletlen tehát, hogy a magas árak ellenére számos ország nagy Tamiflu- (egy oseltamivir származék) vásárlásba kezdett. Az igény akkora, hogy a gyógyszert jelenleg gyártó svájci Roche cég képtelen eleget gyártani, és egyre inkább hajlik rá, hogy belemenjen abba, hogy mások is gyártsák, ami egyebek mellett valószínűleg az árak letöréséhez is vezetne [7].
A felszíni glikoproteinek antigenitása gyakran megváltozik (tehát az immunrendszer „többé nem ismeri fel”), s ez az alapja az influenzajárványoknak. E változásnak két módját ismerjük:
- Antigen drift: pontmutációk következtében a glikoproteinek egy-egy aminosava változik meg
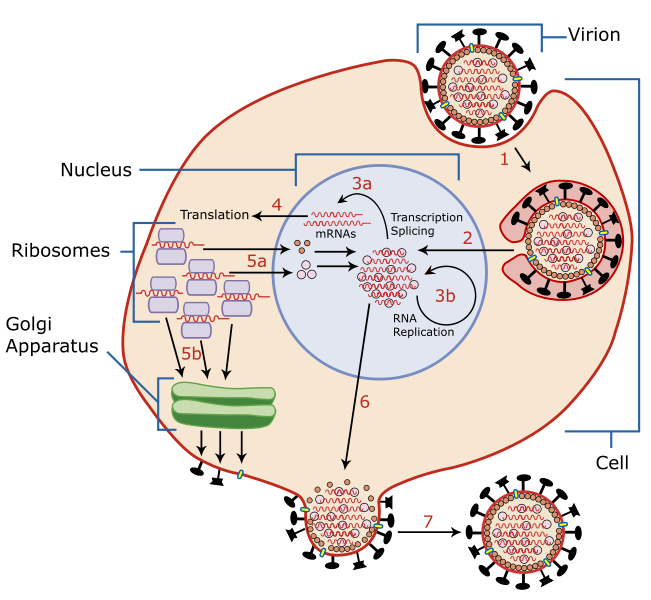
- Antigen shift: akkor következhet be, ha egyazon sejtet többféle vírus is megfertőz. Ilyenkor genetikai rekombináció jön létre, tehát a két vírusgenom elegyéből új változatok alakulnak ki. A rekombináció alapja, hogy a vírusgenom több különálló RNS-szegmensből áll, melyek tehát könnyedén „összekeveredhetnek egymással”. Az antigen shift jelenségét csak az A típusú influenzavírusok esetében figyelték meg. Magyarországon a járványveszélyes időszak október elejétől április végéig tart.A fertőző váladék (pl. köhögéskor aeroszolként) bejut a gazdaszervezet légútjaiba, ahol a vírus hemagglutininje révén kapcsolódik a légúti hámsejtek sziálsav-receptoraihoz. A sejt ezután bekebelezi a vírust, majd az a sejtmagba kerül. A sejtmagban a negatív RNS-ekből mRNS-ek (pozitív RNS) képződnek, melyek virális fehérjék és negatív RNS-ek képzésére késztetik a sejtet. Ezekből aztán új vírusok „szerelődnek össze” a sejtben, majd a sejthártya egy részét magukkal víve kijutnak a légutak lumenébe. A fertőzött hámsejt pedig végül elpusztul.
ImmunitásAz immunrendszer a hemagglutinin és neuraminidáz glikoproteineket ismeri fel antigénként, ellenük antitestek termelődnek. A hemagglutinin elleni antitestek csökkentik a fertőzés valószínűségét (neutralizáló ellenanyagok), a neuraminidáz-ellenes ellenanyagok pedig a betegség súlyosságát és a beteg fertőzőképességét csökkentik.
Antigen drift esetén a megváltozott antigenitású vírus képes lehet megbetegíteni a korábbi változat ellen védett egyedet, de a betegség lefolyása enyhébb. Antigen shift során viszont olyan új vírustörzsek keletkezhetnek, melyek ellen a szervezet védtelen. A fertőzött sejtek elpusztításában citotoxikus T-limfociták vesznek részt.





Nincsenek megjegyzések:
Megjegyzés küldése