Hormonális fogamzásgátlás:
előrelépések és problémák
A hormonális fogamzásgátlásnak számos formája van, hatásmechanizmusaik között az ovulációgátlás, a méhnyaknyák minőségének és/vagy az endometriumnak a megváltoztatása, ezen keresztül a beágyazódás megelőzése szerepel. A fogamzásgátló hatás mellett a hormonális fogamzásgátlásnak számos további előnyét is leírták, pl. csökkentik az endometrium és a petefészekrák rizikóját, kontrollálják a menstruációs vérzést és csökkentik a visszatérő medencei fájdalmat.
A hormonális fogamzásgátlás mai formáinak kialakításáig számos módosításokat végeztek, hogy csökkentsék a mellékhatásokat, hogy javítsák a hatékonyságot és a compliance-t, és hogy 21 napnál hosszabb ideig is szedni lehessen az aktív tablettát, amivel halasztható vagy megelőzhető lenne a menstruációs vérzés.
Elsőként csökkenteni kezdték az ösztrogén és a progesztin dózisát, így alakultak ki a mai kis dózisú készítmények; később kevesebb androgénhatású újabb progesztineket fejlesztettek ki, míg legújabban a tolerálhatóságot, compliance-t és a kezelés kényelmét javító alternatív adagolórendszereket (transzdermális, vaginalis, implantálható és injekciós formák) alakítottak ki.
A "Fertility and Sterility" című lapban olvasható összefoglaló közlemény bemutatja a legújabb adagolórendszereket és hormonális fogamzásgátló formákat, összegzi a sürgősségi fogamzásgátlással kapcsolatos legújabb ismereteket, és áttekinti a hormonális fogamzásgátlás daganatkockázatra, cardiovascularis betegségekre és csontokra gyakorolt hatását. Az összefoglaló legfontosabb megállapításai az alábbiakban olvashatók:
1. A hormonális fogamzásgátlás a reverzíbilis fogamzásgátlás biztonságos és hatékony formája.
2. Az eddigi adatok szerint az új transzdermális, injekciós, vaginalis és implantálható adagolási módszerek biztonságossága és hatékonysága megegyezik az orális kontraceptívumokéval.
3. Az orális fogamzásgátlók a módosítások (aktív tabletták hosszabb idejű szedése, kis dózisú ösztrogének, újabb progesztinek kifejlesztése) ellenére megőrizték fogamzásgátló hatékonyságukat, és mellékhatásprofiljuk kedvezőbb lehet.
4. Az ösztrogén/progesztin kombinációt vagy csak progesztint tartalmazó sürgősségi fogamzásgátlók védekezés nélküli együttlét után hatékonyan csökkentik a terhesség kockázatát. A csak progesztint tartalmazó készítmények hatékonyabbak lehetnek és kevesebb mellékhatásuk lehet.
5. A medroxiprogeszteron-acetát depó injekció és 20 ug etinilösztradiolt tartalmazó OC-k használata mellett kismértékben csökkenhet a csontsűrűség (BMD).
6. Korábbi vagy aktuális OC-használat esetén csökken az endometrium- és a petefészekrák incidenciája.
7. Tartós OC-használat esetén emelkedhet a méhnyakrák rizikója. Az OC-k a HPV kofaktoraként működhetnek a méhnyakrák kialakulásában.
8. A korábbi vagy aktuális OC-használat nem növeli az emlőrák életre szóló kockázatát. A 35 évnél fiatalabb nőkön négyéves OC-használat után kismértékű reverzíbilis kockázatnövekedést figyeltek meg. A 35-64 éves nők korcsoportjában nem figyeltek meg kockázatnövekedést.
9. A stroke és a szívinfarktus rizikója a fogamzóképes korú nők körében kicsi, de emelkedik az OC-t használó 35 év feletti, dohányzó nőknél.
10. A mélyvénás thrombosis rizikója OC-t szedőkön emelkedik, és magasabb a prothrombotikus állapotot eredményező mutációt hordozó nőknél. Aktuálisan csak azokban az esetekben javasolt az OC beállítása előtt thrombophilia irányú kivizsgálás, akinek a kórelőzményében vagy a családi anamnézisében thrombosis szerepel (Fertil Steril 2008;90:S103-13.).NuvaRing 0,120 mg/0,015 mg/24 óra hüvelyben alkalmazott gyógyszerleadó rendszer teljes alkalmazási előírás
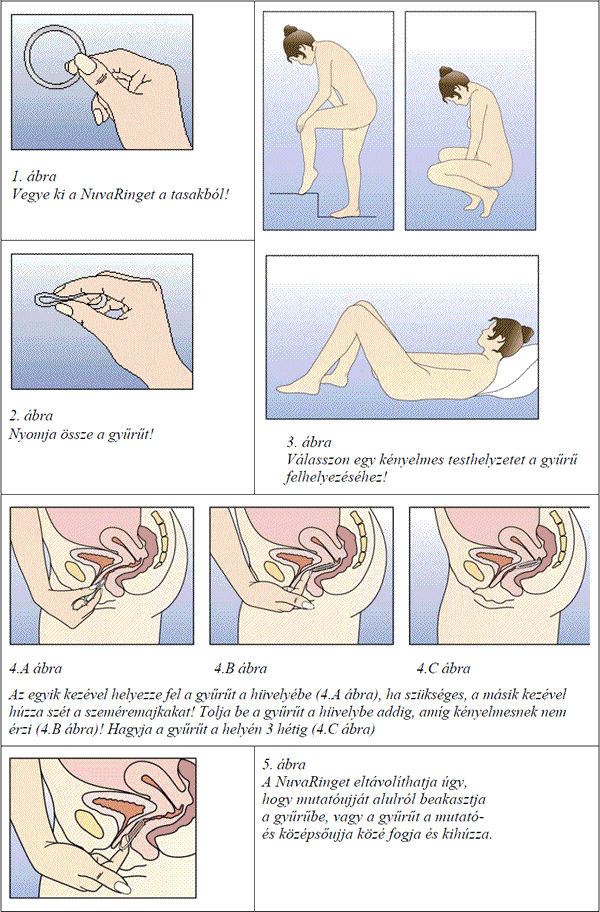
Hogyan kell a NuvaRinget használni?
A nők saját maguk fel tudják helyezni a NuvaRinget a hüvelybe. Az orvosnak fel kell világosítania a nőt, miként helyezze fel és távolítsa el a NuvaRinget. A felhelyezéshez a nőnek a számára legkényelmesebb testhelyzetet kell kiválasztania, például állóhelyzetben, az egyik lábat felemelve, leguggolva vagy fekve. A NuvaRinget össze kell nyomni, és addig kell a hüvelyben feltolni, amíg az kényelmes nem lesz. A NuvaRing hüvelyen belüli pontos elhelyezkedése a gyűrű fogamzásgátló hatása szempontjából nem lényeges (lásd 1 - 4. ábra).
A hüvelybe helyezést követően (lásd "Hogyan kell elkezdeni használni a NuvaRinget?") a gyűrű 3 héten keresztül folyamatosan a hüvelyben marad. Jó, ha a nők rendszeresen ellenőrzik a NuvaRing meglétét. Ha a NuvaRing véletlenül kiesik, a nőnek a 4.2 pont utasításait kell követni: "Mit kell tenni, ha a gyűrű ideiglenesen kikerült a hüvelyből?" (bővebb információért lásd még 4.4 pont: "Kiesés"). A NuvaRinget 3 hét után kell eltávolítani a hétnek ugyanazon a napján, amelyen felhelyezésre került. Egy hét - gyűrűmentes időszak - után új gyűrűt kell felhelyezni (így ha a NuvaRing egy szerdai napon, 22 óra körül lett felhelyezve, 3 hét múlva ugyancsak szerdán, 22 óra körül kell eltávolítani. A következő szerdán új gyűrűt kell felhelyezni). A NuvaRing eltávolításához a mutatóujjat alulról be kell akasztani a gyűrűbe vagy a gyűrűt a mutató- és középsőujj közé kell fogni és kihúzni (5. ábra). A használt gyűrűt be kell tenni a tasakba (gyermekektől és háziállatoktól elzárni) és a 6.6 pontban leírtaknak megfelelően kidobni. A megvonásos vérzés általában a NuvaRing eltávolítását követő 2‑3. napon kezdődik és előfordulhat, hogy nem fejeződik be teljesen a következő gyűrű felhelyezésének esedékessége előtt.
Hogyan kell elkezdeni használni a NuvaRinget?
Amennyiben a megelőző ciklusban nem alkalmaztak hormonális fogamzásgátlót
A NuvaRinget a természetes női ciklus első napján kell felhelyezni (azaz a menstruációs vérzés első napján). A gyűrűt el lehet kezdeni alkalmazni a 2-5. napon is, de az első ciklus során kiegészítésként egy barrier módszert is ajánlott alkalmazni a NuvaRing használatának első 7 napján.
Váltás kombinált fogamzásgátlóról
A nő legkésőbb az előzőleg használt kombinált hormonális fogamzásgátlójának szokásos tablettamentes, tapaszmentes időszakát vagy a placebo tabletta szedésének időszakát követő napon helyezze fel a NuvaRinget!
Ha a nő az előző módszert következetesen és megfelelően használta, és kellően bizonyos abban, hogy nem terhes, a ciklusának bármely napján áttérhet a korábbi kombinált hormonális fogamzásgátlóról.
Az előző módszer hormonmentes időszakát soha nem szabad a javasolt időtartamon túl meghosszabbítani.
Váltás csak progesztagén tartalmú módszerről (minipill, implantátum vagy injekció), illetve progesztagént kibocsátó intrauterin renszerről [IUS]
A nő a minipill szedésének bármely napján áttérhet (az implantátumról vagy az IUS-ről azok eltávolítása napján, az injekcióról akkor, amikor a következő injekció esedékes lenne), de ezen esetek mindegyikénél kiegészítésként egy barrier módszert is alkalmazni kell a NuvaRing alkalmazásának első 7 napján.
Első trimeszter alatt bekövetkezett abortuszt követően
A nő azonnal elkezdheti alkalmazni. Ha így tesz, nincs szükség további fogamzásgátló intézkedések megtételére. Ha az azonnali váltás nem kívánatos, a nő kövesse az " Amennyiben a megelőző ciklusban nem alkalmaztak hormonális fogamzásgátlót " című rész utasításait és tájékoztatni kell arról, hogy ez idő alatt kiegészítésként alkalmazzon alternatív fogamzásgátló módszert.
Szülést vagy második trimeszter alatt bekövetkezett abortuszt követően
Szoptató nők tekintetében lásd a 4.6 pontot.
A nőket tájékoztatni kell, hogy az alkalmazást a szülést vagy a második trimeszter alatt bekövetkezett abortuszt követő negyedik héten kezdjék el Ha később kezdik el, a nőket tájékoztatni kell arról, hogy kiegészítésként alkalmazzanak egy barrier módszert a NuvaRing alkalmazásának első 7 napja során. Ugyanakkor, ha már történt szexuális érintkezés, a NuvaRing alkalmazása előtt ki kell zárni a terhességet, vagy meg kell várni az első menstruációs periódust.
Eltérések az ajánlott adagolási rendtől
A fogamzásgátlás hatékonyságát és a ciklus szabályozását veszélyeztetheti, ha a nő eltér az ajánlott adagolási rendtől. Amennyiben a nő eltér az adagolási rendtől, a fogamzásgátlás hatékonyságának elvesztését kerülendő az alábbiakat kell tanácsolni:
- Mit kell tenni, ha a gyűrűmentes időszak meghosszabbodott?
A nő egyből helyezzen fel új gyűrűt, amint eszébe jut! A következő 7 nap során kiegészítésként egy barrier módszert, például óvszert kell használni. Ha a gyűrűmentes időszak alatt szexuális érintkezés történt, számolni kell a terhesség lehetőségével. Minél hosszabb a gyűrűmentes időszak, annál nagyobb a terhesség kockázata.
- Mit kell tenni, ha a gyűrű ideiglenesen kikerült a hüvelyből?
A NuvaRinget 3 hétig folyamatosan a hüvelyben kell hagyni. Ha a gyűrű véletlenül kiesett, hideg vagy langyos (de nem meleg) vízzel le lehet öblíteni, és azonnal vissza kell helyezni.
Ha a NuvaRing kevesebb mint 3 órán át volt a hüvelyen kívül, a fogamzásgátlás hatékonysága nem csökken. A nőnek amilyen gyorsan lehet, de legkésőbb 3 órán belül vissza kell helyeznie a gyűrűt.
Ha a NuvaRing az alkalmazás első vagy második hete során több mint 3 órán át volt a hüvelyen kívül, vagy felmerül ennek gyanúja, csökkenhet a fogamzásgátlás hatékonysága. A nőnek vissza kell helyeznie a gyűrűt, amilyen gyorsan eszébe jut. Egy barrier módszert, például óvszert kell használni addig, amíg a NuvaRing 7 napig folyamatosan nincs a hüvelyben. Minél hosszabb ideig volt hüvelyen kívül a gyűrű, és minél közelebb történt ez a gyűrűmentes időszakhoz, annál nagyobb a terhesség kockázata.
Ha a NuavRing a 3 hetes alkalmazás harmadik hete során több mint 3 órán át volt a hüvelyen kívül, vagy felmerül ennek gyanúja, a fogamzásgátlás hatékonysága csökkenhet. A nő dobja el ezt a gyűrűt, és válassza a következő két lehetőség egyikét:
1. Azonnal helyezzen fel új gyűrűt!
Megjegyzés: az új gyűrű felhelyezésével elkezdődik a következő három hetes alkalmazási időszak. Előfordulhat, hogy a nő nem tapasztal megvonásos vérzést az előző ciklusban. Ugyanakkor áttöréses vérzés vagy pecsételés előfordulhat.
2. Várja meg a megvonásos vérzést és helyezzen fel új gyűrűt, legkésőbb az előző gyűrű eltávolítását vagy kiesését követő 7 nappal (7×24 óra).
Megjegyzés: ezt a lehetőséget csak akkor válassza, ha a gyűrűt folyamatosan használta a megelőző 7 nap során.
- Mit kell tenni, ha a gyűrű használatának ideje meghosszabbodott?
Bár nem ez a javasolt adagolási rend, de amíg a NuvaRinget maximum 4 hétig alkalmazzák, a fogamzásgátlás hatékonysága továbbra is megfelelő. A nő továbbra is megszakíthatja egy hétre a gyűrű alkalmazását, majd ezután felhelyez egy új gyűrűt. Ha a NuvaRing több mint 4 héten át bent maradt, a fogamzásgátlás hatékonysága csökkenhet, és a terhességet ki kell zárni az új NuvaRing felhelyezése előtt.
Ha a nő nem tartotta magát pontosan a javasolt adagolási rendhez, és ennek következtében nem alakul ki megvonásos vérzés a gyűrűmentes időszakban, a terhességet ki kell zárni az új NuvaRing felhelyezése előtt.
Hogyan kell elcsúsztatni vagy késleltetni a menstruációt?
Ha kivételesen késleltetni kell a menstruációt, a nő felhelyezhet egy új gyűrűt anélkül, hogy beiktatna egy gyűrűmentes időszakot. A következő gyűrűt ismét legfeljebb 3 hétig lehet alkalmazni. A nő vérzést vagy pecsételést tapasztalhat. A szokásos egy hetes gyűrűmentes időszak után folytatható a NuvaRing szabályos alkalmazása.
Annak a nőnek, aki a jelenlegi alkalmazás szerint megszokott napról egy másik napra szeretné csúsztatni a menstruációját, az tanácsolható, hogy annyi nappal rövidítse meg a következő gyűrűmentes időszakot, amennyivel szeretné. Minél rövidebb a gyűrűmentes időszak, annál nagyobb a kockázata, hogy nem lesz megvonásos vérzése, illetve, hogy áttöréses vérzést és pecsételést fog tapasztalni a következő gyűrű használata során.
4.3 Ellenjavallatok
A NuvaRing egyetlen, alább felsorolt állapot fennállása esetén sem alkalmazható. Ha bármely állapot a NuvaRing alkalmazása közben jelenik meg először, a gyűrűt azonnal el kell távolítani.
- Jelenleg fennálló vagy kórtörténetben szereplő vénás trombózis, tüdőembóliával vagy anélkül.
- Jelenleg fennálló vagy kórtörténetben szereplő artériás trombózis (például cerebrovascularis történés, myocardialis infarctus), illetve egy trombózis bevezető tünetei (például angina pectoris vagy transiens ischaemiás attack).
- Vénás vagy artériás trombózisra való ismert, örökletes vagy nem örökletes hajlam, így pl. Aktivált Protein C (APC) rezisztencia, antithrombin-III-hiány, protein C-hiány, protein S-hiány, hyperhomocysteinaemia és antiphospholipid antitestek (anticardiolipin antitestek, lupus antikoaguláns).
- Kórtörténetben szereplő migrén focalis neurológiai tünetekkel.
- Diabetes mellitus érrendszeri érintettséggel.
- A vénás vagy artériás trombózis egyik súlyos vagy több kockázati tényezőjének megléte ugyancsak ellenjavallatot képezhet (lásd a "Különleges figyelmeztetések és az alkalmazással kapcsolatos óvintézkedések" című pontban).
- Jelenleg fennálló vagy kórtörténetben szereplő pancreatitis, ha súlyos hypertriglyceridaemiával összefüggésben lépett fel.
- Jelenleg fennálló vagy kórtörténetben szereplő súlyos májbetegség, amíg a májfunkció-értékek nem térnek vissza a normálértékre.
- Jelenleg fennálló vagy kórtörténetben szereplő májtumor (jóindulatú vagy rosszindulatú).
- A nemi szervek, illetve az emlő ismert vagy feltételezhető rosszindulatú betegségei, amennyiben azok nemi hormonokra érzékenyek.
- Nem diagnosztizált hüvelyi vérzés.
- A NuvaRing hatóanyagaival vagy bármely segédanyagával szembeni túlérzékenység.
4.4 Különleges figyelmeztetések és az alkalmazással kapcsolatos óvintézkedések
Figyelmeztetések
Ha bármely, alább megjelölt állapot/kockázati tényező fennáll, a NuvaRing alkalmazásának előnyeit a lehetséges kockázatokkal szemben - minden egyes nőnél - mérlegelni kell, és meg kell beszélni velük, mielőtt az alkalmazás elkezdése mellett döntenek. Ezen állapotok vagy kockázati tényezők bármelyikének súlyosbodása, fellángolása vagy első alkalommal való feltűnése esetén a nő keresse fel kezelőorvosát! Az orvosnak ezt követően dönteni kell a további alkalmazásról vagy az alkalmazás abbahagyásáról.
Az alábbi adatok mindegyike a szájon át bevehető kombinált fogamzásgátlókról nyert epidemiológiai adatokon alapul. Nincs rendelkezésre álló epidemiológiai adat a hormonok hüvelyi úton való beadásáról, de a figyelmeztetések a NuvaRing-re is alkalmazhatónak bizonyulnak.
1. Keringési betegségek
- A hormonális fogamzásgátlók alkalmazása összefüggésbe hozható a vénás trombózis (mélyvénás trombózis és pulmonáris embólia) és az artériás trombózis megjelenésével, valamint a velejáró szövődményekkel, esetenként halálos következményekkel.
- Bármely kombinált hormonális fogamzásgátló alkalmazása magában hordja a vénás thromboembolia (VTE) kockázatának megnövekedését ahhoz képest, ha nem alkalmazzuk azokat. A megnövekedett kockázat kisebb, mint a terhességgel összefüggésbe hozható VTE kockázata, amely 60/100 000 terhes nőévre becsülhető. A VTE az esetek 1-2%-ában halálos.
Nem ismert, hogy a NuvaRing más kombinált hormonális fogamzásgátlókhoz képest hogyan befolyásolja a kockázatot.- Rendkívül ritkán, trombózis előfordulását jelentették más véredényekben, például máj, mezenterikus, vese, agy vagy retina erekben kombinált orális fogamzásgátlót alkalmazóknál.
- A vénás vagy artériás trombózis tünetei lehetnek: szokatlan, féloldali lábfájás és/vagy duzzanat; hirtelen fellépő, súlyos mellkasi fájdalom, a bal karba való kisugárzással vagy anélkül; hirtelen jelentkező légszomj; hirtelen fellépő köhögési roham; bármilyen szokatlan, súlyos, huzamos fejfájás; hirtelen fellépő részleges vagy teljes látászavar; kettőslátás; zavaros beszéd vagy aphasia; vertigo; ájulás, fokális rohammal vagy a nélkül; gyengeség vagy nagyon nagyfokú zsibbadás, amely hirtelen a test egyik oldalát vagy egy részét érinti; motoros zavarok; "akut" has.
- A vénás thromboembolia (VTE) kockázata növekszik:
- az életkor előrehaladtával;
- pozitív családi kórtörténet esetén (azaz, ha valaha előfordult vénás thromboembolia egy testvérnél vagy szülőnél viszonylag fiatal életkorban). Ha gyanítható az örökletes hajlam, a nőt szakorvoshoz kell utalni és vele konzultálni, mielőtt bármilyen hormonális fogamzásgátló alkalmazása mellett döntenénk;
- elhúzódó immobilitás, nagyobb műtéti beavatkozás, bármilyen, a lábat érintő műtéti beavatkozás vagy nagyobb trauma esetén. Ezekben az esetekben az alkalmazást javasolt abbahagyni (elektív műtétek esetén legalább négy héttel korábban), és csak a teljes felépülést követő két hét elteltével újrakezdeni.
- elhízáskor (testtömegindex 30 kg/m2 felett);
- és lehetséges, hogy felszínes thrombophlebitis, illetve visszértágulat esetén is. Ezen állapotoknak a vénás trombózis etiológiájában játszott lehetséges szerepe tekintetében még nem alakult ki konszenzus.
- Az artériás thromboemboliás szövődmények kockázata növekszik:
- az életkor előrehaladtával;
- dohányzással (az erős dohányzással és az életkor előrehaladtával a kockázat tovább növekszik, különösen a 35 éven felüli nőknél);
- dyslipoproteinaemia fennállása esetén;
- elhízással (testtömegindex 30 kg/m2 felett);
- magas vérnyomással;
- migrénnel;
- valvularis szívbetegség fennállása esetén;
- pitvarfibrilláció fennállása esetén;
- pozitív családi kórtörténet esetén (ha valaha előfordult artériás trombózis egy testvérnél vagy szülőnél viszonylag fiatal életkorban). Ha gyanítható az örökletes hajlam, a nőt szakorvoshoz kell utalni és vele konzultálni, mielőtt bármilyen hormonális fogamzásgátló alkalmazása mellett döntenénk.
- Biokémiai tényezők, amelyek a vénás vagy artériás trombózis örökletes vagy szerzett hajlamára utalhatnak, beleértve az Aktivált Protein C (APC) rezisztanciát, a hyperhomocysteinaemiát, az antithrombin-III-hiányt, a protein C-hiányt, a protein S-hiányt, az antiphospholipid antitesteket (anticardiolipin antitestek, lupus antikoaguláns).
- Egyéb egészségügyi állapotok, amelyek nemkívánatos keringési eseményekkel hozhatók összefüggésbe, beleértve a diabetes mellitust, a szisztémás lupus erythematosust, a haemolyticus uraemiás szindrómát, a krónikus gyulladásos bélbetegséget (például Crohn-betegség vagy colitis ulcerosa).
- Számolni kell a thromboembolia megnövekedett kockázatával a puerperiumban (az információkat lásd a 4.6 "Terhesség és szoptatás" című pontban).
- A migrén gyakoribbá válása vagy súlyosbodása (amely egy cerebrovascularis esemény előjele lehet) okot adhat a NuvaRing alkalmazásának azonnali felfüggesztésére.
- A kombinált orális fogamzásgátlókat használó nők figyelmét kifejezetten fel kell hívni arra, hogy keressék fel kezelőorvosukat, amennyiben trombózis lehetséges tüneteit tapasztalják. Trombózis gyanúja, vagy annak megerősítése esetén a kombinált orális fogamzásgátló alkalmazását abba kell hagyni. A véralvadásgátló terápia teratogenitása miatt (kumarinok) megfelelő fogamzásgátlást kell elkezdeni.
2. Tumorok
- Néhány epidemológiai vizsgálat rámutat, hogy az orális fogamzásgátlók hosszan tartó alkalmazása - a humán papillomavírussal (HPV) fertőzött nőknél - kockázati tényezőt jelent a méhnyakrák kialakulása szempontjából. Ugyanakkor még mindig vitatott, hogy ezt a megállapítást milyen mértékben befolyásolják zavaró tényezők (így pl. különbségek a szexuális partnerek számában, vagy a fogamzásgátlók alkalmazásában). Nem áll rendelkezésre adat a méhnyakrák kockázatára a NuvaRing használói körében (lásd "orvosi vizsgálat/konzultáció").
- Ötvennégy epidemológiai vizsgálat meta-analízise alapján kis mértékben megnövekedik a relatív kockázata (RR = 1,24) az emlőrák diagnosztizálásának azoknál a nőknél, akik a vizsgált időszakban kombinált orális fogamzásgátlót alkalmaznak. A fokozott kockázat a kombinált orális fogamzásgátló alkalmazásának abbahagyását követő 10 év során fokozatosan visszatér a normál mértékre. Mivel az emlőrák 40 éves kor alatti nőknél ritkán fordul elő, az emlőrák össz kockázatához viszonyítva a kombinált orális fogamzásgátlót jelenleg illetve nemrégiben szedők körében csak kevéssel több a diagnosztizált emlőrák száma. A diagnosztizált emlőrák azoknál, akik valaha alkalmaztak kombinált orális fogamzásgátlót általában kevésbé előrehaladott, mint azoknál, akik soha nem alkalmaztak. A megnövekedett kockázat okai lehetnek a kombinált orális fogamzásgátlót alkalmazóknál történő korábbi emlőrák-diagnosztizálás, a kombinált orális fogamzásgátlók biológiai hatásai, vagy a kettő együtt.
- Ritkán jóindulatú májdaganatot, még ritkábban rosszindulatú májdaganatot jelentettek kombinált orális fogamzásgátlókat alkalmazóknál. Ezek a daganatok elszigetelt esetekben életveszélyes hasűri vérzéshez vezettek. Ezért a differenciáldiagnózisban számításba kell venni a májdaganat lehetőségét, amikor a nőknél NuvaRing alkalmazásakor komoly felhasi fájdalom, a máj megnagyobbodása vagy hasűri vérzésre utaló panaszok jelentkeznek.
3. Egyéb állapotok
- Hypertriglyceridaemiás nőknél, vagy azoknál akiknek a családi kórtörténetében ez előfordult, nagyobb lehet a pancreatitis kockázata hormonális fogamzásgátlók alkalmazásakor.
- Bár sok hormonális fogamzásgátlót alkalmazó nőnél jelentették a vérnyomás kis mértékű emelkedését, ritka a klinikailag releváns emelkedés. Nem állapítottak meg kifejezett kapcsolatot a hormonális fogamzásgátlók alkalmazása és a klinikai hypertonia között. Ugyanakkor ha tartós, klinikailag jelentős hypertonia fejlődik ki a NuvaRing alkalmazása közben, tanácsos, hogy az orvos felfüggessze a gyűrű alkalmazását, és kezelje a hypertoniát. Adott esetben, vissza lehet térni a NuvaRing alkalmazásához, ha a normotenzív értékek vérnyomáscsökkentő kezeléssel elérhetőek.
- Az alábbi állapotok megjelenését vagy rosszabbodását jelentették terhesség és hormonális fogamzásgátlók alkalmazása során is, de nincs bizonyíték arra, hogy ezek összefüggésbe hozhatók-e az alkalmazással: cholestasishoz kapcsolódó sárgaság és/vagy pruritus; epekő kialakulása; porphyria; szisztémás lupus erythematosus; haemolyticus uraemiás szindróma; Sydenham-féle chorea; herpes gestationis; ostosclerosissal összefüggő hallásvesztés, (örökletes) angiooedema.
- Akut vagy krónikus májfunkciózavarok szükségessé tehetik a NuvaRing alkalmazásának felfüggesztését, amíg a májfunkció értékei vissza nem térnek a normális szintre. Cholestatikus sárgaság és/vagy előzőleg terhesség alatt, vagy korábbi szex szteroidok alkalmazása során jelentkezett cholestasis következtében kialakuló pruritus újbóli megjelenése szükségessé teheti a gyűrű használatának felfüggesztését.
- Bár az ösztrogének és a progesztagének hatással lehetnek a perifériás inzulin rezisztanciára és a glülóz toleranciára, nincs bizonyíték arra, hogy a hormonális fogamzásgátlót alkalmazó diabéteszes nőknél szükség van-e a terápiás adagolási rend megváltoztatására. Ugyanakkor a cukorbeteg nőket gondosan ellenőrizni kell a NuvaRing alkalmazásakor, különösen az alkalmazás első hónapjaiban.
- A Crohn-betegség és a colitis ulcerosa rosszabbodását jelentették hormonális fogamzásgátlók alkalmazásával kapcsolatban.
- Időnként előfordulhat chloasma, különösen olyan nőknél, akiknek a kórtörténetében chloasma gravidarum szerepel. Chloasmára hajlamos nők kerüljék az erős napsugárzást és az UV-sugárzást a NuvaRing alkalmazása során!
- Ha egy nőnél a következő állapotok valamelyike fennáll, lehet, hogy nem fogja tudni megfelelően felhelyezni a NuvaRing-et vagy elveszíti a gyűrűt: méhnyak prolapsusa, cystocele és/vagy rectocele, súlyos vagy krónikus székrekedés.
Nagyon ritkán jelentették, hogy a NuvaRing-et véletlenül a húgycsőbe helyezték fel, és előfordult, hogy a húgyhólyagba jutott. Ezért cystitis tünetei esetén a differenciáldiagnózis során számolni kell a helytelen felhelyezés lehetőségével.- A NuvaRing alkalmazása során a nők alkalmanként vaginitist tapasztalhatnak. Nincs arra utaló jel, hogy a NuvaRing hatásosságát befolyásolná a vaginitis kezelése, sem arra, hogy a NuvaRing alkalmazása befolyásolná a vaginitis kezelését (lásd a 4.5 "Gyógyszerköcsönhatások és egyéb interakciók" című pontot).
Orvosi vizsgálat/konzultáció
A NuvaRing alkalmazásának elkezdése vagy újrakezdése előtt szükség van teljes orvosi anamnézis (beleértve a család orvosi anamnézisét is) felvételére, és ki kell zárni a terhességet. Meg kell mérni a vérnyomást és fizikális vizsgálatot kell végezni, az ellenjavallatok (4.3 pont) és a figyelmeztetések (4.4 pont) figyelembe vételével. A nőt tájékoztatni kell, hogy figyelmesen olvassa el a betegtájékoztatót és kövesse a benne található utasításokat. A további, rendszeres ellenőrzések gyakoriságát és természetét a kialakult klinikai gyakorlat alapján kell megállapítani és személyre szabottan kell alkalmazni.
Fel kell világosítani a nőket, hogy a NuvaRing nem nyújt védelmet a HIV-fertőzéssel (AIDS) és egyéb nemi úton terjedő betegségekkel szemben.
Csökkent hatékonyság
A NuvaRing hatékonysága csökkenhet az együttműködés hiánya ("non-compliance") (4.2 pont), illetve egyidejű gyógyszerszedés esetén (4.5 pont).
Gyengébb cikluskontroll
A NuvaRing alkalmazása során előfordulhat szabálytalan vérzés (pecsételő vagy áttöréses vérzés). Ha azután lép fel szabálytalan vérzés, hogy a NuvaRing javasolt alkalmazási rend szerinti használata során a ciklusok szabályosan követték egymást, akkor nem hormonális eredetű okokra kell gondolni, és megfelelő diagnosztikai vizsgálatokat kell végezni a rosszindulatú betegség vagy a terhesség kizárása érdekében. Ezek közé tartozhat a curettage is.
Néhány nőnél előfordulhat, hogy a gyűrűmentes időszakban nem jelentkezik megvonásos vérzés. A NuvaRing 4.2 pontban leírt utasítások szerinti alkalmazása esetén valószínűtlen, hogy a nő terhes. Ugyanakkor, ha a NuvaRing-et az első megvonásos vérzést megelőzően nem ezen utasítások szerint használták, vagy ha két megvonásos vérzés kimaradt, a NuvaRing további alkalmazása előtt ki kell zárni a terhességet.
Férfiak etinilösztradiolnak és etonogesztrelnek való kitettsége
A férfi szexuális partnerek péniszén keresztül abszorbeált etinilösztradiol és etonogesztrel expozíciójának lehetséges farmakológiai szerepét és annak mértékét nem vizsgálták.
ELTÖRT gyűrűk
Nagyon ritka esetekben jelentették, hogy a NuvaRing alkalmazás közben eltört (lásd 4.5 pont "Interakciók"). A nőnek el kell mondani, hogy távolítsa el az eltört gyűrűt és amint lehet, helyezzen fel egy újat, és kiegészítésként használjon egy barrier módszert, pl. óvszert, az elkövetkezendő 7 nap során. Számolni kell a terhesség lehetőségével, és a nőnek fel kell keresnie kezelőorvosát.
Kiesés
A NuvaRing kieséséről számoltak be, például ha a gyűrűt nem megfelelően helyezték fel, tampon kivétele közben, szexuális érintkezés során vagy súlyos, illetve krónikus székrekedés esetén. Amennyiben a gyűrű hosszú időre kikerül, a fogamzásgátlás hatástalanná válik és/vagy megvonásos vérzés alakulhat ki. Ezért a hatékonyság biztosítása érdekében fel kell hívni a nő figyelmét, hogy rendszeresen ellenőrizze a NuvaRing meglétét.
Ha a NuvaRing véletlenül kiesett, és kevesebb, mint 3 órán át volt a hüvelyen kívül, a fogamzásgátlás hatékonysága nem csökken. A nő öblítse le a gyűrűt hideg vagy langyos (nem meleg) vízzel, és helyezze vissza, amilyen gyorsan lehetséges, de legkésőbb 3 órán belül!
Ha a NuvaRing több, mint 3 órán át gyaníthatóan vagy valójában a hüvelyen kívül volt, a fogamzásgátlás hatékonysága csökkenhet. Ebben az esetben a 4.2 "Mit kell tenni, ha a gyűrű ideiglenesen kikerült a hüvelyből?" című részben található utasításokat kell követni.
4.5 Gyógyszerkölcsönhatások és egyéb interakciók
Interakciók
A hormonális fogamzásgátlók és más gyószerek közötti interakciók áttöréses vérzéshez és/vagy a fogamzásgátlás sikertelenségéhez vezethetnek. A következő interakciókat jelentették a szakirodalomban.
Máj anyagcsere: interakció léphet fel olyan gyógyszerekkel, amelyek mikroszomális enzimeket indukálnak, ami a szexhormonok fokozott kiürülését okozhatja (pl. fenitoin, fenobarbitál, primidon, karbamazepim, rifampicin és esetleg oxkarbazepin is, topiramát, felbamát, ritonavir, grizeofulvin és lyukaslevelű orbáncfű tartalmú készítmények).
Azok a nők, akiket ezen gyógyszerek bármelyikével kezelnek, a NuvaRing mellé ideiglenesen egy barrier módszert is kell alkalmazniuk, vagy más fogamzásgátló módszert kell válasszanak. A hepatikus mikroszómális enzimeket indukáló gyógyszerekkel való együttes alkalmazás alatt és a velük való kezelés befelyezése után 28 napig a barrier módszert alkalmazni kell.
Ha a 3 hetes gyűrűs ciklusnál hosszabb ideig alkalmazzuk egyidejűleg a gyógyszert, a következő gyűrűt azonnal, a gyűrűmentes időszakot kihagyva, fel kell helyezni.
A fogamzásgátlás sikertelenségét antibiotikumokkal kapcsolatban is jelentették, így penicillineknél és tetraciklineknél is. Ennek a hatásnak a mechanizmusa nem tisztázott. Egy farmakokinetikai interakciós vizsgálatban - a NuvaRing alkalmazása során - a 10 napon át szájon át adott amoxicillin (875 mg, naponta kétszer) vagy doxiciklin (200 mg az első napon, majd napi 100 mg) nem befolyásolta jelentősen az etonogesztrel és az etinilösztradiol farmakokinetikáját. Antibiotukus kezelés alatt álló nőknek (az amoxicillin és a doxiciklin kivételével) a kezelés befelyezése után 7 napig barrier módszert kell alkalmazniuk. Ha a 3 hetes gyűrűs ciklusnál hosszabb ideig alkalmazzuk egyidejűleg a gyógyszert, a következő gyűrűt azonnal, a gyűrűmentes időszakot kihagyva, fel kell helyezni.
Farmakokinetikai adatok alapján nem valószínű, hogy a hüvelyen keresztül adott antimikotikumok és spermicidek befolyásolják a NuvaRing fogamzásgátló hatékonyságát és biztonságosságát. Az antimikotikus hüvelykúpok alkalmazása során a gyűrű szétszakadásának az esélye valamivel nagyobb (lásd 4.4 "Eltört gyűrűk" című rész).
A hormonális fogamzásgátlók befolyásolhatják más gyógyszerek metabolizmusát. Ennek megfelelően a plazma- illetve szöveti koncentráció nőhet (pl. ciklosporin ) vagy csökkenhet (pl. lamotrigin).
Az együtt alkalmazott gyógyszerek alkalmazási előírását - a lehetséges interakciók megismerése érdekében - el kell olvasni.
Laboratóriumi vizsgálatok
A fogamzásgátló szteroidok használata befolyásolhatja egyes laboratóriumi vizsgálatok eredményét, többek között a máj, a pajzsmirigy, a mellékvese és a vese működésének biokémiai paramétereit, a transzportfehérjék plazmaszintjét (pl. kortikoszteroid-kötő globulin és nemi hormon-kötő globulin), a lipid / lipoprotein frakciókat, a szénhidrát-anyagcsere paramétereit és a véralvadás és fibrinolízis paramétereit. A változások általában a normál laboratóriumi határértékek között maradnak.
Kölcsönhatás tamponnal
A farmakokinetikai adatok azt mutatják, hogy a tampon használata nincs hatással a NuvaRing által kibocsátott hormonok szisztémás felszívódására. Ritkán a tampon kivételekor a NuvaRing kieshet (tanácsért lásd a "Mit kell tenni, ha a gyűrű ideiglenesen kikerült a hüvelyből" című részt).
4.6 Terhesség és szoptatás
A NuvaRing terhesség alatti alkalmazása nem javallt. Ha terhesség alakulna ki, amíg a NuvaRing a helyén van, a gyűrűt el kell távolítani. Kiterjedt epidemiológiai vizsgálatok nem igazoltak fokozott kockázatot - a terhességet megelőzően kombinált orális fogamzásgátlót használó nők gyermekeinél - a születési rendellenességek tekintetében, sem a teratogén hatás tekintetében, ha a kombinált orális fogamzásgátlót nem szándékosan a korai terhesség alatt használták.
Egy, kis számú nővel végzett klinikai vizsgálat kimutatta, hogy az intravaginális alkalmazás ellenére a fogamzásgátló szteroidok intrauterin koncentrációja a NuvaRing-nél hasonló, mint a kombinált orális fogamzásgátlót szedőknél (lásd 5.2 pont). A NuvaRing hatásának kitett terhességek kimeneteléről nincs klinikai tapasztalat.
A szoptatást befolyásolhatják az ösztrogének, mivel csökkenthetik az anyatej mennyiségét és megváltoztathatják az összetételét. Ezért a NuvaRing alkalmazását általában nem szabad javasolni, amíg az anya teljesen le nem választja a gyermeket. A fogamzásgátló szteroidok és/vagy metabolitjainak kis mennyisége kiválasztódhat a tejjel, de nincs bizonyíték arra, hogy ez károsan befolyásolná az újszülött egészségét.
4.7 A készítmény hatásai a gépjárművezetéshez és gépek kezeléséhez szükséges képességekre
Farmakodinámiás tulajdonságai alapján a NuvaRing várhatóan nem vagy csak elhanyagolható mértékben befolyásolja a gépjárművezetéshez és gépek kezeléséhez szükséges képességeket.
4.8 Nemkívánatos hatások, mellékhatások
A NuvaRinggel végzett klinikai vizsgálatok során jelentett leggyakoribb mellékhatás a fejfájás, a hüvelyi fertőzések és a hüvelyi folyás volt, melyek mindegyikét a nők 5-6%-a jelentette.
A NuvaRinggel végzett klinikai vizsgálatok során jelentett gyógyszermellékhatásokat az alábbi táblázat tünteti fel. Az egyes nemkívánatos események legmegfelelőbb MedDRA (9.1 verzió) kifejezései találhatók az alábbi táblázatban.
Szervrendszer
Gyakori
>= 1/100 - <1/10
Nem gyakori
>= 1/1000 - <1/100
Forgalomba helyezést követően1
Fertőző betegségek és parazitafertőzések
Hüvelyi fertőzés
Cervicitis, cystitis, húgyúti fertőzés
Immunrendszeri betegségek és tünetek
Túlérzékenység
Anyagcsere- és táplálkozási betegségek és tünetek
Fokozott étvágy
Pszichiátriai kórképek
Depresszió, csökkent libidó
Érzelmi labilitás, hangulatváltozás, hangulatingadozás
Idegrendszeri betegségek és tünetek
Fejfájás, migrén
Szédülés, hypaesthesia
Szembetegségek és szemészeti tünetek
Látászavar
Érbetegségek és tünetek
Hőhullám
Emésztőrendszeri betegségek és tünetek
Hasi fájdalom, hányinger
Has felfúvódása, hasmenés, hányás, székrekedés
A bőr és a bőralatti szövet betegségei és tünetei
Acne
Alopecia, eczema, pruritus, kiütés
Csalánkiütés
A csont-izomrendszer és a kötőszövet betegségei és tünetei
Hátfájás, izomgörcsök, végtagfájdalom
Vese- és húgyúti betegségek és tünetek
Dysuria, sürgető vizelési inger, gyakori vizeletürítés
A nemi szervekkel és az emlőkkel kapcsolatos betegségek és tünetek
Az emlő érzékenysége, a női genitáliák viszketése, dysmenorrhoea, kismedencei fájdalom, hüvelyi folyás
Amenorrhoea, az emlők diszkomfort érzése, emlőmegnagyobbodás, csomó az emlőben, cervicalis polyp, kontakt‑vérzés, fájdalmas közösülés, ectropium cervicis, mastopathia fibrosa cystica, hüvelyváladékozás, menorrhagia, metrorrhagia, kismedencei diszkomfort, prementstruációs szindróma, uterus spasmus, égő érzés a hüvelyben, hüvelyszag, hüvelyi fájdalom, vulvovaginalis diszkomfort, vulvovaginalis szárazság
Általános tünetek, az alkalmazás helyén fellépő reakciók
Fáradtság, ingerlékenység, rossz közérzet, ödéma, idegen test érzése
Laboratóriumi vizsgálatok eredményei
Testtömeg-növekedés
Vérnyomás-emelkedés
Sérülés, mérgezés és a beavatkozással kapcsolatos szövődmények
A gyógyászati segédeszköz okozta kényelmetlenség, a hüvelyi fogamzásgátló eszköz kiesése
A fogamzásgátló eszköz használatából származó szövődmény, az eszköz eltörése
1) A nemkívánatos események felsorolása spontán bejelentések alapján. A pontos gyakoriságot nem lehet meghatározni.
Post-marketing megfigyelés során a NuvaRinget alkalmazó nők partnereinél ritkán a pénisz elváltozásairól számoltak be.
Számos mellékhatást jelentettek kombinált orális fogamzásgátlókat alkalmazó nőkkel kapcsolatban, melyeket a 4.4 "Különleges figyelmeztetések és az alkalmazással kapcsolatos óvintézkedések" című pont részletesen tárgyal. Ezek közé tartoznak:
- vénás thromboemboliás betegségek;
- artériás thromboemboliás betegségek;
- hypertonia;
- hormonfüggő tumorok (pl. májtumor, emlőrák);
- chloasma.
4.9 Túladagolás
Nem számoltak be hormonális fogamzásgátló túladagolásával kapcsolatban súlyos károsító hatásokról. Az ilyen esetben az alábbi tünetek fordulhatnak elő: hányinger, hányás és fiatal lányoknál hüvelyi vérzés. Nincsenek antidotumok, a további kezelést tünetileg kell folytatni.
5. FARMAKOLÓGIAI TULAJDONSÁGOK
5.1 Farmakodinámiás tulajdonságok
Farmakoterápiás csoport: Progesztagént és ösztrogént tartalmazó hüvelygyűrű,
ATC kód: G02BB01
A NuvaRing etonogesztrelt és etinilösztradiolt tartalmaz. Az etonogesztrel egy 19-nortesztoszteron-eredetű progesztagén és nagy affinitással kötődik a progeszteron receptorokhoz a célszervekben. Az etinilösztradiol egy, a fogamzásgátló készítményekben elterjedten használt ösztrogén. A NuvaRing fogamzásgátló hatása többféle mechanizmuson alapul, melyek legfontosabbika az ovuláció gátlása.
Hatékonyság
Világszerte (US, EU és Brazília) végeztek klinikai vizsgálatokat 18 és 40 év közötti nőkön. A fogamzásgátló-hatékonyság legalább összehasonlíthatónak bizonyult a kombinált orális fogamzásgátlókéval. Az alábbi táblázat megmutatja a NuvaRing klinikai vizsgálatai során megállapított Pearl-indexeket (terhességek száma/100 felhasználó nőév)
Analitikus módszer
Pearl-index
95% CI
Ciklusok száma
ITT (felhasználó + módszer hiba)
0,96
0,64 - 1,39
37 977
PP (módszer hiba)
0,64
0,35 - 1,07
28 723
A magasabb dózisú kombinált orális fogamzásgátlók (0,050 mg etinilösztradiol) alkalmazása során az endometrium- és ovariumrák kockázata csökken. Még nem tisztázott, hogy ez egy alacsonyabb dózisú fogamzásgátló, így a NuvaRing esetén is így van-e.
A vérzés jellege
Egy széles körű, 150/30 ľg levonorgesztrel/etinilösztradiol tartalmú orális fogamzásgátlóval (n = 512 ill. n = 518) végzett összehasonlító vizsgálatban, melyben a hüvelyi vérzés jellemzőit 13 cikluson át értékelték, a NuvaRing használata esetén az áttöréses pecsételő vérzés vagy vérzés előfordulási gyakorisága alacsony volt (0,2‑6,4%). Továbbá, a legtöbb vizsgált személy esetén (58,8 - 72,8%) a hüvelyi vérzés előfordulása a gyűrűmentes időszakra korlátozódott.
A csont ásványianyag denzitására kifejtett hatások
A NuvaRing csont ásványianyag-denzitásra (BMD) kifejtett hatásait (n = 76) a nem hormonális méhenbelüli eszközökkel (IUD) összehasonlítva (n = 31), két éven át tartó vizsgálatban értékelték. Nem figyeltek meg semmilyen csonttömeget érintő mellékhatást.
5.2 Farmakokinetikai tulajdonságok
Etonogesztrel
Felszívódás
A NuvaRing által leadott etonogesztrel gyorsan abszorbeálódik a hüvely nyálkahártyáján keresztül. Az etonogesztrel szérum-koncentrációja a felhelyezés után kb. 1 héttel eléri a mintegy 1700 pg/ml-es maximumot. A szérum-koncentráció enyhe fluktuációt mutat és 3 hét alatt lassan 1400 pg/ml-re csökken. Az abszolút biohasznosulás hozzávetőleg 100%-os, ami magasabb, mint orális alkalmazás esetén. A cervicalis és intrauterin etonogesztrelszintet kis számú nőnél mérték, akik NuvaRing-et használtak vagy 0,150 mg dezogesztrelt és 0,020 mg etinilösztradiolt tartalmazó fogamzásgátlót szedtek orálisan. A megfigyelt szintek hasonlók voltak.
Megoszlás
Az etonogesztrel szérumalbuminhoz és szexhormon-kötő globulinhoz (SHBG) kötődik. Az etonogesztrel látszólagos megoszlási térfogata 2,3 l/kg.
Metabolizmus
Az etonogesztrel az ismert szteroid anyagcsereutakon keresztül metabolizálódik. A látszólagos szérum clearance 3,5 l/h. Nem találtak direkt interakciót az együtt alkalmazott etinilösztradiollal.
Elimináció
Az etonogesztrel szérumszintje két fázisban csökken. A terminális eliminációs fázist mintegy 29 órás felezési idő jellemzi. Az etonogesztrel és metabolitjai 1,7:1 arányban a vesén és az epén keresztül választódnak ki. A metabolitok kiválasztásának felezési ideje kb. 6 nap.
Etinilösztradiol
Felszívódás
A NuvaRing által leadott etinilösztradiol gyorsan abszorbeálódik a hüvely nyálkahártyáján keresztül. A 35 pg/ml-es maximum szérum-koncentrációt a behelyezés után 3 nappal éri el, majd 3 hét alatt 18 pg/ml-re csökken. A havi szisztémás etinilösztradiol expozíció (AUC0-w) a NuvaRing esetében 10,9 ngˇh/ml. Az abszolút biohasznosulás hozzávetőleg 56%, ami hasonló az etinilösztradiol orális alkalmazásánál tapasztalthoz. A cervicalis és intrauterin etinilösztradiolszintet kis számú nőnél mérték, akik NuvaRing-et használtak vagy 0,150 mg dezogesztrelt és 0,020 mg etinilösztradiolt tartalmazó fogamzásgátlót szedtek orálisan. A megfigyelt szintek hasonlók voltak.
Megoszlás
Az etinilösztradiol nagymértékben, de nem specifikusan kötődik a szérumalbuminhoz. Látszólagos megoszlási térfogatként 15 l/kg-ot mértek.
Metabolizmus
Az etinilösztradiol elsődlegesen aromás hidroxilációval metabolizálódik, de sokféle hidroxilált és metilált metabolit is képződik. Ezek jelen vannak szabad metabolitok és szulfát illetve glükuronid konjugátumok formájában is. A látszólagos clearance 35 l/h.
Elimináció
Az etinilösztradiol szérumszintje két fázisban csökken. A terminális eliminációs fázist a felezési idő nagy egyéni varianciája jellemzi, melynek középértéke kb. 34 óra. Az etinilösztradiol változatlan formában nem ürül; az etinilösztradiol metabolitjai 1,3:1 arányban a vesén és az epén keresztül választódnak ki. A metabolitok kiválasztásának felezési ideje kb. 1,5 nap.
5.3 A preklinikai biztonságossági vizsgálatok eredményei
Az etinilösztradiolra és az etonogesztrelre vonatkozó hagyományos - farmakológiai biztonságossági, ismételt dózistoxicitási, genotoxicitási, karcinogenitási, reprodukciós toxicitási - vizsgálatokból származó nem klinikai jellegű adatok azt igazolták, hogy a készítmény nem jelent különleges veszélyt az emberre.






Nincsenek megjegyzések:
Megjegyzés küldése